
FISIOTERAPIA EN EL ADULTO CRÍTICO CON SDRA POR COVID-19
William Cristancho Gómez
Introducción
La fisioterapia es una profesión liberal del área de la salud caracterizada por el ejercicio autónomo el cual se sustenta en sólidos conocimientos científico-tecnológicos y en la apropiación óptima de una dimensión ética adquirida a lo largo de la formación y el ejercicio profesional. Además, en la profesión son relevantes: 1. El aporte intelectual que permite, desde elevados procesos mentales, proponer teorías y confirmarlas, o descartarlas desde el quehacer teórico-práctico y desde procesos investigativos rigurosos; 2. El conocimiento derivado de la confrontación cotidiana entre la plataforma conceptual y la realidad, desde la cual se estimula la abstracción, cualidad formal propia del pensamiento científico; y 3. La técnica comprendida y manejada de manera idónea y, perfeccionada por los continuos retos profesionales; existe además una fuerte conciencia de grupo que permite fortalecer colectivamente todas las dimensiones y dominios fisioterapéuticos. Estos elementos permiten determinar un cimiento lógico para la construcción de uno de los pilares más importantes de la práctica profesional: el diagnóstico fisioterapéutico, elemento incluido en el modelo de gestión de la fisioterapia, en el que se integran cinco piezas clave para maximizar los resultados en el paciente: examinación, evaluación, diagnóstico, pronóstico, e intervención (figura 1). Este modelo de gestión sirve de marco para la toma de decisiones clínicas y provee a los fisioterapeutas de un lenguaje común para describir y ejercer la práctica clínica. Los pasos del modelo se desarrollan de manera secuencial comenzando por el examen y terminado en la intervención, después de la cual se realiza un proceso de reexaminación para reiniciar la secuencia o interrumpirla si se han alcanzado los objetivos del Proyecto Terapéutico (alta) o si se produce la interrupción por diversas causas (figura 2).
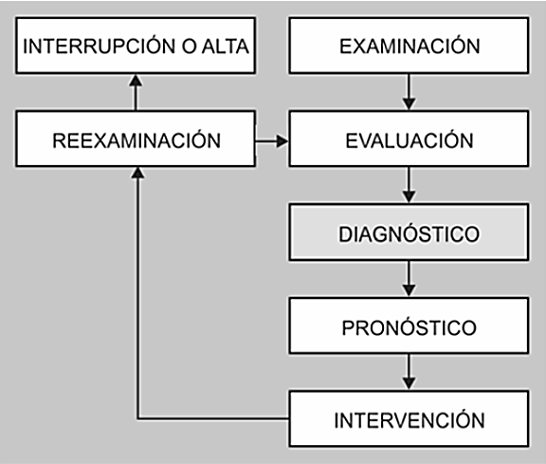
Figura 1. Modelo de gestión de la Fisioterapia
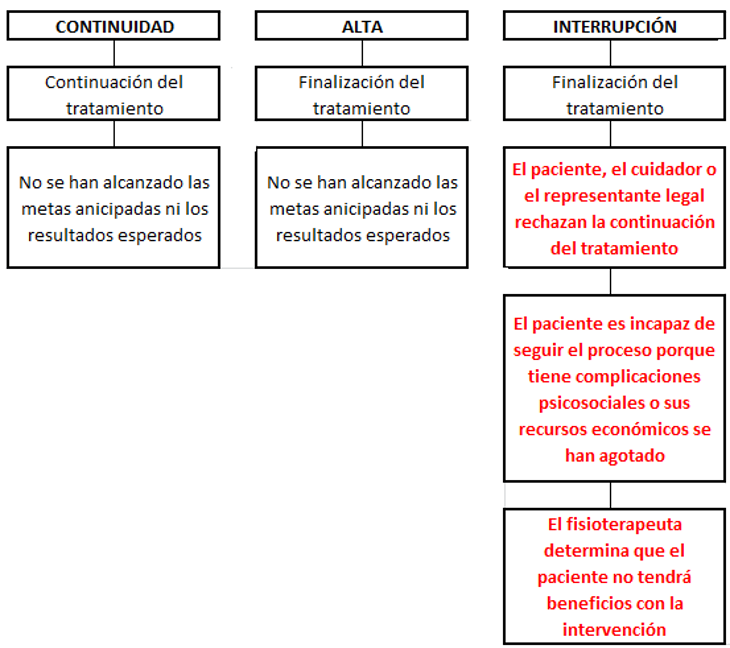
Figura 2. Opciones posteriores a la re-examinación
A diferencia del modelo médico en el que el énfasis principal está en el diagnóstico y el tratamiento de la enfermedad, el modelo fisioterapéutico cambia el enfoque sobre las consecuencias funcionales de esta. El modelo examina el impacto de enfermedades crónicas y agudas sobre el funcionamiento de sistemas orgánicos específicos (deficiencias), explora el desempeño humano básico (limitaciones funcionales), y determina el funcionamiento normal de las personas, junto a las expectativas y roles personales deseados dentro de la sociedad (discapacidad). Así por ejemplo, un paciente internado en la UCI con diagnóstico médico de SDRA severo por COVID-19, tendrá el siguiente diagnóstico fisioterapéutico genérico: “Deficiencia grave en la estructura y las funciones del sistema respiratorio que produce limitación extrema del intercambio gaseoso. Limitación de moderada a grave para el desarrollo de actividades y restricción completa para la participación. Se conforma con los datos obtenidos un contexto de discapacidad transitoria”. Entonces, los fisioterapeutas evalúan las relaciones entre las deficiencias, limitaciones funcionales y discapacidades, con el fin de clasificar a los pacientes, desarrollar un pronóstico, y determinar las intervenciones directas para remediar las limitaciones funcionales. Estas acciones terapéuticas se realizan sobre los dominios de intervención de la fisioterapia identificados por la World Confederation for Physical Therapy (WCPT), los cuales han sido clásicos dentro de la práctica de la profesión (figura 3). En este orden de ideas, los resultados de la intervención de fisioterapia se evalúan en función de: 1. La solución de las limitaciones funcionales y la discapacidad, 2. La optimización de la satisfacción del paciente, y 3. La prevención, ya sea primaria o secundaria.

Figura 3. Los cuatro dominios clásicos de intervención de la fisioterapia
INTERVENCIÓN FISIOTERAPÉUTICA EN EL DOMINIO CARDIO-RESPIRATORIO EN SDRA POR COVID-19
El Síndrome Respiratorio Agudo Severo del Coronavirus 2 (SARS-CoV2) 1-3 conocido como enfermedad de coronavirus 2019 (COVID-19) es una entidad infecciosa reportada en diciembre de 2019, fecha desde la que múltiples publicaciones han coincidido en la caracterización, estratificación y propuestas de manejo.1-4 Por tratarse esencial, pero no exclusivamente de un proceso mórbido con afectación respiratoria se ha establecido una clasificación dependiente de la progresión del cuadro, en: enfermedad leve, neumonía, neumonía severa, SDRA (leve, moderado o severo), sepsis y, choque séptico,5 lo que permite establecer y optimizar la admisión, el tratamiento, y la derivación a salas de mayor complejidad (UCI) (Figura 4).
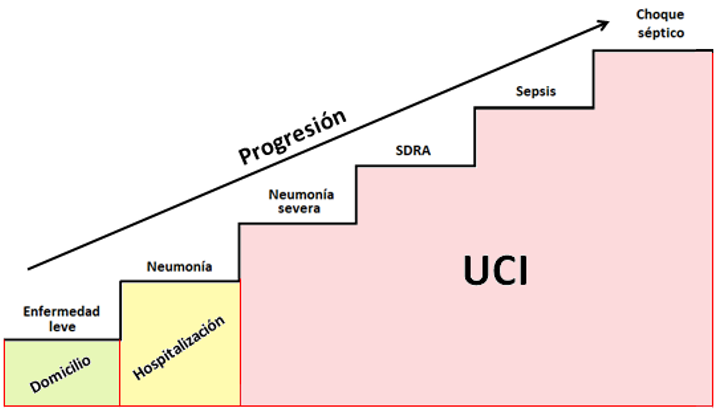
Figura 4. Esquema de la progresión de la enfermedad por COVID-19.
Podría asumirse que, el paciente con SDRA por COVID-19 que ingresa a la UCI proviene de uno de los siguientes tres escenarios: 1. Paciente admitido a institución de salud con franco cuadro de insuficiencia respiratoria aguda hipoxémica (IRA Tipo 1), y requiere ingreso inmediato a UCI para soporte ventilatorio, 2. Paciente remitido de salas de urgencias u hospitalización, en las que se detecta progresión del cuadro hacia la falla ventilatoria, por hipoxemia refractaria caracterizada por pobre-nula respuesta a la oxigenoterapia, 3. Paciente de cualquier origen, con deterioro progresivo de la función ventilatoria, con factores de riesgo asociados con la insuficiencia respiratoria que requieren ventilación mecánica: edad avanzada (mayor de 60 años), sexo masculino y, presencia de comorbilidades subyacentes como diabetes, malignidad, inmunosupresión, enfermedades cardiovasculares y/o respiratorias crónicas, e hipertensión.6-9
Desde el punto de vista de soporte ventilatorio, el SDRA constituye el reto más grande para el equipo de cuidado respiratorio. El síndrome se tipifica según la clasificación de Berlín10 en leve, moderado y severo, lo cual permite mediante escalamiento establecer pautas de manejo según su gravedad. Así por ejemplo, para el SDRA leve se ha propuesto la oxigenoterapia convencional; para el moderado el uso de oxigenoterapia con cánula nasal de alto flujo (CNAF) y ventilación mecánica no invasiva (VNI), mientras que, en el SDRA severo la utilización de ventilación mecánica (VM) invasiva es imperativa (figura 5).
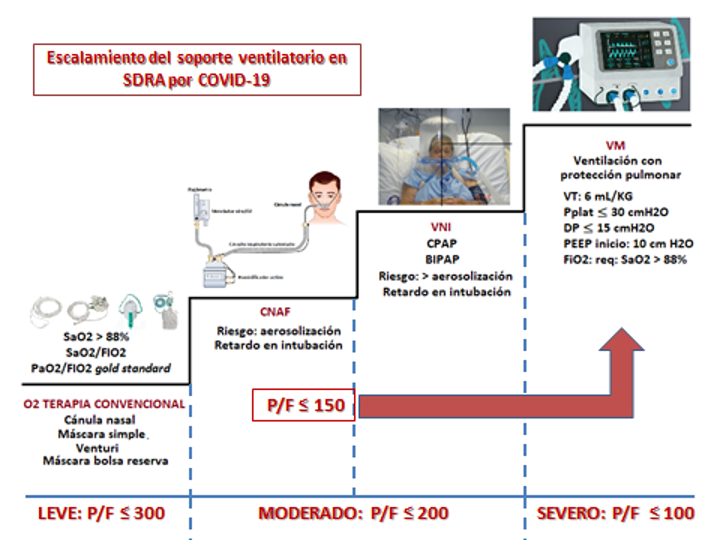
Figura 5. Escalamiento del soporte del SDRA según gravedad. El valor de la PaO2/FiO2 ≤150 es determinante para iniciar VM Invasiva, a pesar de que éste, corresponde a SDRA moderado
Sin embargo, estas propuestas son controvertidas (excepto la realizada para el SDRA severo). La terapia con CNAF, a pesar de que reduce la necesidad de intubación15 podría retardarla, y además, no disminuye la mortalidad;16-18 sin embargo, la reducción en la necesidad de intubación es un hallazgo importante, particularmente desde la perspectiva de pandemias como COVID-19, donde los recursos como camas de UCI y ventiladores pueden convertirse en factores de limitación terapéutica.8 Los pacientes con hipercapnia (exacerbación de la enfermedad pulmonar obstructiva, edema pulmonar cardiogénico), inestabilidad hemodinámica, falla multiorgánica o estado mental anormal generalmente no deben recibir CNAF. Las pautas basadas en evidencia sobre CNAF no son contundentes, y los informes sobre su uso en pacientes infectados con otro coronavirus [Middle East Respiratory Syndrome (MERS)] son limitados.19 No obstante, para los adultos con COVID-19 e insuficiencia respiratoria hipoxémica aguda a pesar de la oxigenoterapia convencional, se ha sugerido usar CNAF, incluso sobre la VNI (recomendación débil, evidencia de baja calidad).8,20
Las guías de VNI no recomiendan su uso en la insuficiencia respiratoria hipoxémica (aparte del edema pulmonar cardiogénico e insuficiencia respiratoria postoperatoria) o enfermedad viral pandémica (en referencia a previos estudios en SARS e influenza pandémica).8 Los riesgos incluyen además de la intubación tardía, la administración de grandes volúmenes corrientes y presiones transpulmonares perjudiciales5 lo que puede gatillar lesión pulmonar autoinflingida.21 Los datos limitados sugieren una alta tasa de fracaso en pacientes con otras infecciones virales como MERS-CoV que reciben VNI.19
La VM invasiva es el último escalón de soporte. Por tratarse de un SDRA debe manejarse como tal, independientemente de su etiología, es decir con la estrategia de “Ventilación protectora”, 22 utilizando un VT de hasta 6 mL/kg (que eventualmente puede ascender a 8 mL/kg), presión plateau por debajo de 30 cmH2O, driving pressure bajo 15 cmH2O, PEEP alto (por lo general sobre 10 cmH2O). Los demás parámetros de inicio (FR, TI. TE, I:E, Rise Time, etc.), se programan teniendo en cuenta la singularidad de cada paciente. La ventilación en prono está indicada en hipoxemia refractaria, implementándola por periodos mínimos de 16 horas.4,20 Se sugiere el uso de maniobras de reclutamiento pulmonar (de 40 cmH2O durante 40 segundos), en lugar de no usar maniobras de reclutamiento (recomendación débil), y no se recomienda usar maniobras de escalamiento (PEEP incremental) (recomendación fuerte).23
La oxigenación con membrana extracorpórea (ECMO) es limitada. En el ensayo EOLIA, el uso temprano de ECMO no mejoró significativamente la mortalidad a los 60 días en pacientes con SDRA grave,24 pero cuando se usa como modalidad de rescate, ECMO podría ayudar a mejorar la supervivencia.25 Como antecedente, en pacientes con infección por un tipo de coronavirus (MERS-CoV), la ECMO versus el tratamiento convencional se asoció con una reducción de la mortalidad en un estudio de cohorte.26 ECMO solo debe ofrecerse en centros expertos con un volumen de casos suficiente para mantener la experiencia y que puedan aplicar las medidas de prevención y control de infecciones requeridas para pacientes adultos y pediátricos con COVID-19.27,28
Cuatro situaciones conexas con la ventilación mecánica deben ser tenidas en cuenta por el fisioterapeuta: 1. El uso de elementos de protección personal (EPP), 2. La humidificación de los gases inspirados, 3. La minimización de la aerosolización de los gases espirados y, 4. La aspiración de secreciones.
El uso de EPP es obligatorio por razones de bioseguridad a lo que se debe agregar una serie de elementos de infraestructura para garantizar la integridad del personal. Sin embargo, esta última condición puede resultar difícil, sobre todo en países con sistemas de salud apenas básicos. Los EPP requeridos son: guantes, bata de manga larga, protección para ojos, tapabocas N95 o equivalente, cubierta para el cabello para procedimientos que generen aerosoles, y zapatos impermeables a los líquidos y que puedan limpiarse. Los elementos de infraestructura “ideales” son: salas individuales con ventilación adecuada preferiblemente con presión negativa que permita 12 cambios/hora a 160L/seg (figura 6).

Figura 6. Condiciones requeridas para garantizar la adecuada bioseguridad durante la intervención fisioterapéutica.
La humidificación de los gases inspirados debe proveerse en los sistemas de circuito doble con intercambiadores de calor y humedad (HME) que pueden optimizar su eficiencia si son electrostáticos (HMEF), éstos se ubican parte distal de la línea inspiratoria entre la pieza en “Y” y el tubo endotraqueal, y la humidificación activa debe ser eliminada. Para la minimización de la aerosolización debe ubicarse un filtro de alta eficiencia para partículas aéreas (HEPA) en la punta proximal de la línea espiratoria (figura 7). Para los sistemas de circuito simple se ubica el HME o HMEF en el codo distal y el HEPA en la válvula espiratoria (figura 7).
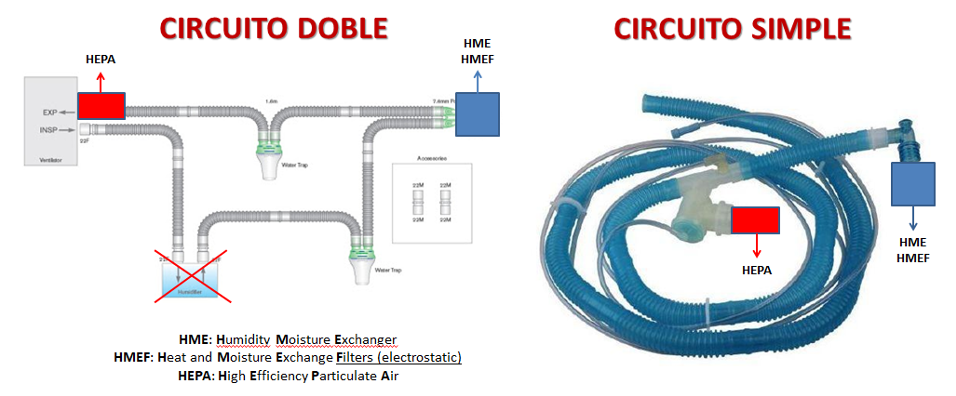
Figura 7. Ubicación del HME, HMEF y HEPA.
Para la aspiración de secreciones se recomienda utilizar sistemas cerrados de succión, los que además de minimizar la pérdida de PEEP durante la succión, minimizan la dispersión e aerosoles (figura 8).5

Figura 8. Sistema cerrado de succión
INTERVENCIÓN FISIOTERAPÉUTICA EN EL DOMINIO NEURO-MÚSCULO-ESQUELÉTICO
Es probable que la autonomía haya sido el logro más importante de la fisioterapia en los últimos 50 años. Tal cualidad permite el ejercicio profesional atendiendo preceptos, teorías, experiencias y evidencias propias; posibilita el uso de instrumentos y sistemas de medición construidos para la examinación-evaluación, los cuales han sido avalados por diversos grupos de trabajo y validados universalmente. El modelo de atención de la fisioterapia permite (e incluso promueve) la utilización de elementos de disciplinas y profesiones afines para nutrir el proceso de recolección de información para el análisis crítico que permite la formulación del diagnóstico fisioterapéutico (DF), concepto vital de la práctica autónoma; así por ejemplo, el diagnóstico médico es un insumo fundamental y de primera línea para el DF y sirve además para definir líneas de conducta que si bien son autónomas, son parte de las propuestas del equipo de trabajo que en últimas busca un objetivo común: en unos casos la recuperación del paciente, en otros la rehabilitación, y por qué no, en otros el cuidado paliativo.
El paciente con diagnóstico médico de SDRA por COVID-19, tiene un DF genérico según la Clasificación Internacional del Funcionamiento, de la Discapacidad y de la Salud (CIF) de: “Deficiencia grave en la estructura y las funciones del sistema respiratorio que produce limitación extrema del intercambio gaseoso. Limitación de moderada a grave para el desarrollo de actividades y restricción completa para la participación. Se conforma con los datos obtenidos un contexto de discapacidad transitoria”. Desde la perspectiva de la American Physical Therapy Association (APTA) el DF corresponde al patrón de práctica F: Deficiencia en la ventilación, respiración, e intercambio de gases con falla respiratoria.29 Es obvio que estos diagnósticos genéricos se modifican después de finalizado el proceso evaluativo, porque la valoración identifica afectación de otros dominios.
En este orden de ideas, el DF permite la elaboración y ejecución de un plan de intervención autónomo, es decir independiente, que se aplicará una vez se surta el proceso de examinación-evaluación, el cual tiene en cuenta, por supuesto, las limitaciones, barreras y contraindicaciones para su ejecución. No es válido eludir o evadir la intervención con el argumento de “falta de experiencia” puesto que, la formación profesional óptima permite actuar con la fuerza de los conocimientos y argumentos propios de la profesión, es decir, se reitera el concepto de autonomía. En el contexto presente, siempre habrá que tener en cuenta que, una vez superada la fase inicial de intubación y estabilización clínica, los pacientes con COVID-19 se comportarán como habituales pacientes críticos intubados, en este caso, como SDRA,30,31 por lo que, un fisioterapeuta de UCI, tendrá los conocimientos y experiencia requeridos para el manejo del SDRA en todos los dominios de actuación siempre y cuando actúe con un justo razonamiento clínico de tipo hipotético deductivo.
Según Thomas et al.,32 la intervención fisioterapéutica en fase aguda del COVID-19 se limita al manejo y control del soporte ventilatorio, y por supuesto, al mantenimiento de la permeabilidad e la vía aérea, pero en el marco de la Fisioterapia intensiva, la movilización y el ejercicio se consideran útiles para cualquier paciente con riesgo significativo de desarrollar -o con evidencia- de limitaciones funcionales significativas, es decir, pacientes frágiles o que tienen múltiples comorbilidades que afectan su independencia y, pacientes de la UCI con deterioro funcional significativo y/o en riesgo de debilidad adquirida en la UCI. Zhonghua et al.,30 proponen al cobertura fisioterapéutica en tres áreas: 1. Manejo de la respiración, 2. Manejo Postural y, 3. Actividades de movilización temprana.
Los pacientes con SDRA a menudo desarrollan disfunción diafragmática y músculo-esquelética severa de las extremidades. La función muscular alterada en el SDRA se relaciona con una mayor mortalidad, mayor duración de la ventilación mecánica y discapacidad funcional en los sobrevivientes. Para atenuar la debilidad muscular de fase temprana y de fase tardía en el SDRA, la movilización temprana (incluso movimiento pasivo) sigue siendo la mejor terapia disponible.33 La movilización temprana de pacientes en la UCI, se ha establecido como una estrategia basada en la evidencia para reducir el desacondicionamiento y la disfunción tan comúnmente vistos en sobrevivientes de enfermedades críticas. Para que esta estrategia sea exitosa, es importante la atención continua para minimizar el uso de sedación. Además, los proveedores de atención en la UCI deben reconocer la importancia de un modelo de atención multidisciplinaria para optimizar la eficacia de la movilización temprana.34
El metaanálisis de Zang et al., de 15 estudios (1 941 pacientes) encontró que la movilización temprana reduce la incidencia de la debilidad muscular adquirida en UCI, acorta duración de la estancia tanto en UCI, como en hospitalización, mejora puntajes del índice Medical Research Council (MRC) y Barthel, y previene la aparición de trombosis venosa, neumonía bacteriana relacionada con el ventilador y úlceras por presión; sin embargo, no se demostró mejoría en la mortalidad ni en días libres de VM.35
Cuándo iniciar la fisioterapia en SDRA por COVID-19
En el paciente con COVID-19 se fomenta la movilización temprana en el curso de la enfermedad cuando sea seguro hacerlo; la prescripción de ésta y del ejercicio debe implicar una consideración cuidadosa del estado del paciente (presentación clínica estable con función respiratoria y hemodinámica estable).5 La fisioterapia se inicia cuando se cumplan varias condiciones (Cuadro 1):30,31
Cuadro 1. Cuándo iniciar la fisioterapia en SDRA por COVID-19

El bloqueo neuromuscular (BNM) ha sido relacionado con debilidad muscular adquirida en UCI.36,37 En el COVID-19 se ha considerado el uso de BNM cuando se presenta una significativa disincronía paciente-ventilador a pesar de la sedación;38 también cuando a pesar de la sedación no se puede lograr de manera confiable la limitación del volumen corriente, o cuando se presenten hipoxemia o hipercapnia refractarias.5 Un ensayo encontró que esta estrategia mejoró la supervivencia en pacientes adultos con SDRA grave (PaO2/FiO2 <150) sin causar debilidad significativa,39 pero los resultados de un ensayo reciente más grande encontraron que el uso del bloqueo neuromuscular con una estrategia de PEEP alta no se asoció con un beneficio de supervivencia en comparación con una estrategia de sedación ligera sin bloqueo neuromuscular.40 En contraste, un metaanálisis reciente respaldó el uso de BNM en pacientes con SDRA de moderado a severo, porque se encontró reducción de la mortalidad en la UCI y en la incidencia de barotrauma; sin embargo, debe usarse con precaución, ya que puede aumentar el riesgo de debilidad adquirida en la UCI.41
Si se utiliza BNM, debería implementarse fisioterapia temprana debido a la evidencia de efectos beneficiosos sobre la fuerza muscular, la función física y la calidad de vida.42 La movilización temprana puede ser una medida efectiva para reducir la debilidad adquirida.43
Examinación-evaluación
La tendencia a estandarizar los instrumentos, escalas y test en la práctica de la fisioterapia ha sido motivada en parte por el reconocimiento de que los objetivos evaluativos no sólo deben estar orientados a la identificación de las deficiencias medidas en función de estructuras y funciones corporales, sino también en función de la ejecución de actividades y participación en diferentes ámbitos de la vida diaria.
Es recomendable realizar la evaluación y el seguimiento de la intervención a través de un instrumento específico de la Fisioterapia. Existen muchos, pero tal vez, el PERME Score,44 que permite evaluar el estado de movilidad de los pacientes en la UCI en un momento específico en el tiempo, satisface las necesidades de la práctica fisioterapéutica, puesto que, éste evalúa estado mental, barreras potenciales para la movilidad, fuerza funcional, movilidad en cama, transferencias, marcha y resistencia. Además, ya ha sido objeto de traducción y adaptación cultural al idioma español.45
Sin embargo, es notable que la evaluación convencional que arropa los equipos sanitarios confiere universalidad a la evaluación, y a la determinación de las limitaciones y barreras para los actos terapéuticos. En este orden de ideas, varios aspectos deben ser evaluados. Las mediciones que determinan la evaluación de la capacidad aérobica deben incluir datos de fácil obtención, (SpO2, PaO2, presión arterial-PA, presión arterial media-PAM), y otros de fácil comprobación con un cronómetro (frecuencia respiratoria y cardiaca) o con datos de historia (por ejemplo, infarto de miocardio o arritmias). No se recurre a instrumentos y test complejos excepto –tal vez- el puntaje de la escala de Borg. Luego se evalúan la ventilación, el intercambio gaseoso, y la respiración, teniendo como insumos los gases sanguíneos (arteriales y venosos, la semiología del tórax y las medidas básicas de mecánica ventilatoria. Seguidamente se procede al registro de la evaluación músculo-esquelética, la cual incluye los datos de presión inspiratoria y espiratoria máximas que reflejan la fuerza de los músculos de la respiración (requieren como instrumento el manovacuómetro); y los resultados del test de fuerza muscular (el instrumento puede ser el MRC o el handgrip). Sigue el registro de la evaluación neuromuscular, nutrida por tres instrumentos, escala de coma de Glasgow, escala de Ashworth modificada y escala de sedación de Rass. Luego se realiza la evaluación integumentaria (en esta es importante registrar la presencia de tubos de drenaje torácico y el estado de la piel en los sitios de fijación del tubo endotraqueal o el estado en los sitios de contacto con sistemas de oxigenoterapia), es relevante evaluar de forma acusiosa las zonas de presión cuando el paciente se ventila en decúbito prono. Puede utilizarse una escala para evaluar el riesgo de aparición de úlcera por presión (escala de Norton). La evaluación de actividades y participación se realiza simplificando éstas a lo más relevante, para lo que se realiza el registro de la existencia o no de limitaciones en actividades de la vida diaria (AVD) y actividades básicas cotidianas (ABC); no obstante, existen escalas de medición de este ítem (como el índice de Barthel), pero no son funcionales en UCI. Al final, con base en todo el proceso evaluativo descrito, se formula el diagnóstico fisioterapéutico.46 Un aspecto de importancia crucial, es que a partir de una evaluación acuciosa se determinan las barreras, y contraindicaciones de la intervención.
Barreras y contraindicaciones para la intervención fisioterapéutica en SDRA por COVID-19
La movilización temprana es segura y viable.47-50 Sin embargo, muchos pacientes de UCI permanecen inmovilizados durante largos periodos, 51-53 quizás por la aparición de barreras que impiden el acto terapéutico,54,55 las cuales comprenden cuatro categorías (Cuadro 2): 1. Barreras relacionadas con el paciente; 2. Barreras estructurales, incluidos los recursos humanos y técnicos; 3. Barreras relacionadas con la cultura de la UCI, incluidos los hábitos, actitudes y contexto dentro de las UCI e instituciones (p. ej., la moral del personal); y 4. Barreras relacionadas con el proceso, incluyendo cómo se prestan servicios y el funcionamiento del personal.
Cuadro 2. Barreras que impiden la intervención
|
Barreras relacionadas con el paciente |
Barreras estructurales |
|
Alta gravedad de la enfermedad, pacientes "demasiado enfermos" o "demasiado bien Inestabilidad hemodinámica, arritmias Inestabilidad-distrés respiratorio Asincronía paciente-ventilador Dolor Pobre estado nutricional Índice de masa corporal, IMC ≥30 Nueva inmovilidad-debilidad Delirium-agitación Rechazo del paciente, falta de motivación Ansiedad Fatiga, necesidad de descanso, somnolencia Cuidado paliativo Dispositivos y equipos de UCI o relacionados con UCI |
Personal limitado, limitaciones de tiempo Falta de programa / protocolo de movilidad temprana Equipo limitado Alta temprana (antes de la movilización) |
|
Barreras relacionadas con el proceso |
Barreras culturales |
|
Falta de planificación y coordinación Expectativas, roles y responsabilidades poco claros Estudios diarios faltantes-retrasados para elegibilidad y orden de reposo en cama Riesgos para los proveedores de movilidad (estrés, lesiones) |
Falta de cultura de movilidad (p. ej., participación inadecuada del personal, falta de cultura multidisciplinaria) Falta de conocimiento y experiencia del personal sobre los riesgos-beneficios de la movilidad Falta de apoyo o aceptación del personal Falta de conocimiento del paciente-familia |
El plan de intervención
El plan de intervención se deriva de la examinación-evaluación. El uso de instrumentos y/o escalas o test de medición para la práctica evaluativa fisioterapéutica es prácticamente una exigencia para consolidar el diagnóstico y formular las estrategias de intervención en UCI. Esto es cierto, sin embargo, también es cierto que la dedicación a las tareas de aplicación de éstos y su registro demanda un tiempo considerable de horas-fisioterapeuta en UCI. Esta dificultad es notable en Latinoamérica puesto que el número de fisioterapeutas y los tiempos de dedicación son escasos, a lo que se suma, la conducta de exigir rendimiento en la práctica diaria, referido al número de pacientes y/o procedimientos realizados por cada turno asistencial. Esta situación quizás se agravará cuando los ingresos de pacientes por COVID-19 se multipliquen
Una vez realizado el proceso de examinación-evaluación y formulado el diagnóstico fisioterapéutico y el pronóstico referido a metas alcanzables, se propone el plan de intervención, para el que, no existen fórmulas aplicables a toda la población debido a la singularidad de cada paciente y a la posibilidad de ejecutar acciones terapéuticas múltiples basadas en el ejercicio de la autonomía profesional y validadas por la experticia en su ejecución. Sin embargo, se propone un marco amplio de actuación teniendo como guía una pirámide de intervención fisioterapéutica (figura 9), cuya base es el posicionamiento e intervención en cama, para luego progresar a actividades de movilización más exigentes, teniendo como objetivo final la deambulación.
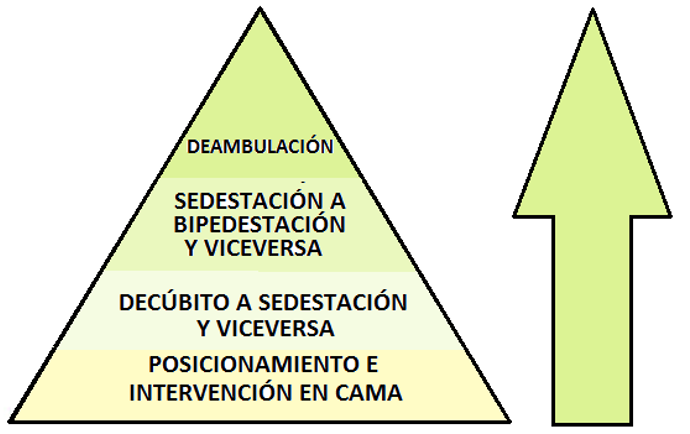
Figura 9. La pirámide de intervención fisioterapéutica
Cuándo suspender la fisioterapia en SDRA por COVID-19
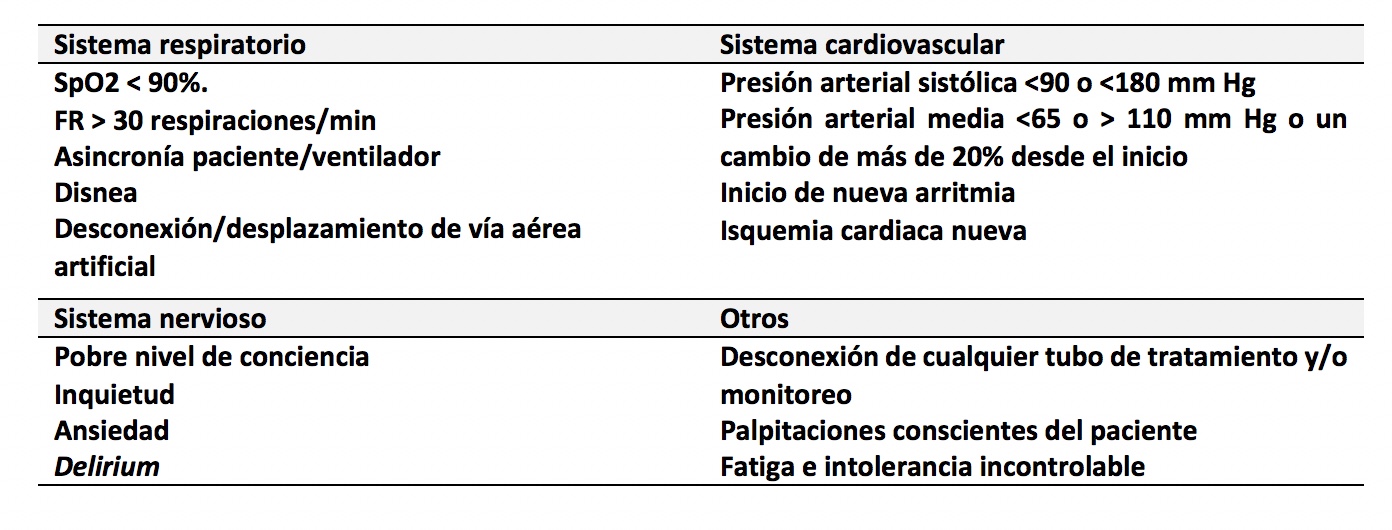
Si se ha elaborado un plan de intervención ajustado a los hallazgos de la examinación-evaluación y el pronóstico fisioterapéutico, pueden aparecer en cualquier fase del proceso, condiciones que indican la suspensión inmediata de la propuesta terapéutica. Estas condiciones se relacionan con hallazgos en el sistema respiratorio, cardiovascular, nervioso y otros (cuadro 3).31)Si la condición encontrada se supera, es viable la reiniciación del proceso, previa evaluación.
Cuadro 3. Cuándo suspender la fisioterapia en SDRA por COVID-19
CONCLUSIONES
El SDRA por COVID-19 plantea nuevos retos en la práctica fisioterapéutica. Por tratarse de SDRA hay una buena parte de camino recorrido en su abordaje, pero por ser el COVID-19 un grave y muy contagioso proceso viral originó una serie de preocupaciones válidas relacionadas con el uso de EPP y medidas de bioseguridad. En la práctica, todos los profesionales de la salud han recibido información y formación sobre las conductas de protección, las que no deberían ser novedosas, puesto que, deberían ser utilizadas en todos los actos terapéuticos sin excepción. Sin embargo, el conocimiento actual de la dispersión de aerosoles, de la contaminación por contacto, y de la letalidad del cuadro, entre otros, ha generado un afán de adquisición de conductas protectoras, esta vez dirigidas no solo al paciente, sino al personal sanitario y a la comunidad en general.
La fisioterapia juega un rol sustantivo en el manejo del SDRA por COVID-19. Los dominios de actuación de la profesión permiten el manejo integral del cuadro. Los procesos de elaboración juiciosa de planes de tratamiento basados en el diagnóstico fisioterapéutico, sustentado este, en la autonomía, han fortalecido la praxis profesional alejándola del pragmatismo reduccionista que suele acompañar los procesos que se mecanizan por la cotidianidad. Es el momento de consolidar la profesión utilizando el razonamiento clínico que permitirá comprender el estado real de los procesos patológicos y su justo manejo, orientado a mejorar la calidad de vida de los pacientes a través de procesos de recuperación y rehabilitación válidos, juiciosos y humanizados.
REFERENCIAS
1. Zhu N, Zhang D, Wang W et al.: A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med 2020;382:727-733.
2. World Health Organization: Pneumonia of unknown cause — China. January 5, 2020 (https://www.who.int/csr/don/05 -january-2020-pneumonia-of-unkown -cause-china/en/).
3. World Health Organization: Novel Coronavirus — China. January 12, 2020 (https://www.who.int/csr/don/12-january -2020-novel-coronavirus-china/en/).
4. Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R et al.: Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med. 2017;43(3):304-77. Epub 2017/01/20. DOI: 10.1007/s00134-017-4683-6. PubMed PMID: 28101605.
5. World Health Organisation: Clinical management of severe acute respiratory infection when novel coronavirus (nCoV) infection is suspected: interim guidance. Available at: https://www.who.int/internalpublications-detail/clinical-management-of-severe-acute-respiratoryinfection-when-novel-coronavirus-(ncov)-infection-is-suspected. Último acceso 20 February 2020.
6. Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, Liu L, Shan H, Lei CL, Hui DSC, Du B, Li LJ et al.: China Medical Treatment Expert Group for C, (2020) Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. DOI:10.1056/NEJMoa2002032.
7. Wu Z, McGoogan JM: Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China: Summary of a Report of 72314 Cases From the Chinese Center for Disease Control and Prevention, 2020. JAMA. DOI: 10.1001/jama.2020.2648.
8. Yang X, Yu Y, Xu J, Shu H, Xia J, Liu H, Wu Y, Zhang L, Yu Z, Fang M, Yu T, Wang Y, Pan S, Zou X, Yuan S, Shang Y: Clinical course and outcomes of critically ill patients with SARS-CoV-2 neumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med, 2020. DOI: 10.1016/S2213-2600(20)30079-5.
9. Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, Wang B, Xiang H, Cheng Z, Xiong Y, Zhao Y, Li Y, Wang X, Peng Z: Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China, 2020. JAMA. DOI: 10.1001/jama.2020.1585.
10. Force ADT, Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, Caldwell E et al.: Acute respiratory distress syndrome: the Berlin Definition. JAMA. 2012;307(23):2526-33. Epub 2012/07/17. DOI: 10.1001/jama.2012.5669. PubMed PMID: 22797452.
11. Rochwerg B, Brochard L, Elliott MW, Hess D, Hill NS, Nava S et al.: Official ERS/ATS clinical practice guidelines: noninvasive ventilation for acute respiratory failure. Eur Respir J. 2017;50(2). Epub 2017/09/02. DOI: 10.1183/13993003.02426-2016. PubMed PMID: 28860265.
12. Ni YN, Luo J, Yu H, Liu D, Liang BM, Liang ZA: The effect of high-flow nasal cannula in reducing the mortality and the rate of endotracheal intubation when used before mechanical ventilation compared with conventional oxygen therapy and noninvasive positive pressure ventilation. A systematic review and meta-analysis. Am J Emerg Med 2018;36: 226-233.
13. Ou X, Hua Y, Liu J, Gong C, Zhao W: Effect of high-flow nasal cannula oxygen therapy in adults with acute hypoxemic respiratory failure: a meta-analysis of randomized controlled trials. CMAJ 2017;189: E260-E267.
14. Rochwerg B, Granton D, Wang DX, Helviz Y, Einav S, Frat JP, Mekontso-Dessap A, Schreiber A, Azoulay E, Mercat A, Demoule A, Lemiale V, Pesenti A, Riviello ED, Mauri T, Mancebo J, Brochard L, Burns K: High flow nasal cannula compared with conventional oxygen therapy for acute hypoxemic respiratory failure: a systematic review and meta-analysis. Intensive Care Med 2019;45:563-572.
15. Luo Y, Ou R, Ling Y, Qin T: [The therapeutic effect of high flow nasal cannula oxygen therapy for the first imported case of Middle East respiratory syndrome to China]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue. 2015;27(10):841-4. Epub 2016/05/03. PubMed PMID: 27132449.
16. Ni YN, Luo J, Yu H, Liu D, Liang BM, Liang ZA: The effect of high-flow nasal cannula in reducing the mortality and the rate of endotracheal intubation when used before mechanical ventilation compared with conventional oxygen therapy and noninvasive positive pressure ventilation. A systematic review and meta-analysis. Am J Emerg Med 2018; 36:226-233.
17. Ou X, Hua Y, Liu J, Gong C, Zhao W: Effect of high-flow nasal cannula oxygen therapy in adults with acute hypoxemic respiratory failure: a meta-analysis of randomized controlled trials. CMAJ 2017; 189: E260-E267.
18. Rochwerg B, Granton D, Wang DX, Helviz Y, Einav S, Frat JP, Mekontso-Dessap A, Schreiber A, Azoulay E, Mercat A, Demoule A, Lemiale V, Pesenti A, Riviello ED, Mauri T, Mancebo J, Brochard L, Burns K: High flow nasal cannula compared with conventional oxygen therapy for acute hypoxemic respiratory failure: a systematic review and meta-analysis. Intensive Care Med 2019;45:563-572.
19. Arabi YM, Arifi AA, Balkhy HH, Najm H, Aldawood AS, Ghabashi A et al.: Clinical course and outcomes of critically ill patients with Middle East respiratory syndrome coronavirus infection. Ann Intern Med. 2014; 160(6):389-97. Epub 2014/01/30. DOI: 10.7326/M13-2486. PubMed PMID: 24474051.
20. Poston J, Patel B, Davis A: Management of Critically Ill Adults With COVID-19. Jama.com. Published online March 26, 2020.
21. Yoshida T, Amato MBP, Kavanagh BP, Fujino Y: Impact of spontaneous breathing during mechanical ventilation in acute respiratory distress syndrome. Current Opinion in Critical Care 2019;25(2):192-198.
22. WeVent: Protocolo respiratorio de paciente con SARS-COV-2 (COVID-19). Disponible en: https://www.formacionsanitaria.eu/index.php/es/wevent?fbclid=IwAR3-v_7JY2K9lRlnVOEIMy1uC5Lb28fML72Dsnrlt_eFHCRDHt1s5jZEmNY. Consultado: 20 marzo 2020.
23. Sahetya SK, Brower RG: Lung recruitment and titrated PEEP in moderate to severe ARDS: is the door closing on the open lung? JAMA 2017; 318: 1327–1332.
24. Combes A et al.: Extracorporeal membrane oxygenation for severe acute respiratory distress syndrome. N Engl J Med 2018;378:1965–1975.
25. Sameed M, Meng Z, Marciniak ET: EOLIA trial: the future of extracorporeal membrane oxygenation in acute respiratory distress syndrome therapy? Breathe 2019; 15: 244–246.
26. Alshahrani MS, Sindi A, Alshamsi F, Al-Omari A, El Tahan M, Alahmadi B et al.: Extracorporeal membrane oxygenation for severe Middle East respiratory syndrome coronavirus. Ann Intensive Care. 2018;8(1):3. Epub 2018/01/14. DOI: 10.1186/s13613-017-0350-x. PubMed PMID: 29330690; PMCID: PMC5768582.
27. Combes A, Brodie D, Bartlett R, Brochard L, Brower R, Conrad S et al.: Position paper for the organization of extracorporeal membrane oxygenation programs for acute respiratory failure in adult patients. Am J Respir Crit Care Med. 2014;190(5):488-96. Epub 2014/07/26. doi: 10.1164/rccm.201404-0630CP. PubMed PMID: 25062496.
28. Munshi L, Walkey A, Goligher E, Pham T, Uleryk EM, Fan E: Venovenous extracorporeal membrane oxygenation for acute respiratory distress syndrome: a systematic review and meta-analysis. Lancet Respir Med. 2019;7(2):163-72. Epub 2019/01/16. DOI: 10.1016/S2213-2600(18)30452-1. PubMed PMID: 30642776.
29. APTA guide: Adapted Practice Patterns. Disponible en: https://www.apta.org/Guide/PracticePatterns/. Consultado: 10/04/2020.
30. Zhonghua Jie He He Hu Xi Za Zhi: Recommendations for respiratory rehabilitation of COVID-19 in adult. 2020, 3, 43(0):E029. DOI: 10.3760/cma.j.cn112147-20200228-00206.
31. Arbillaga A, Pardàs M, Escudero R et al.: Fisioterapia Respiratoria en el Manejo del Paciente con Covid-19: Recomendaciones Generales Área De Fisioterapia Respiratoria Sociedad Española De Neumología Y Cirugía Torácica –SEPAR. 26 marzo 2020.
32. Thomas P, Baldwin C, Bissett B, Boden I, Gosselink R, Granger CL, Hodgson C, Jones AY, Kho ME, Moses R, Ntoumenopoulos G, Parry SM, Patman S, van der Lee L: Physiotherapy management for COVID-19 in the acute hospital setting: clinical practice recommendations, Journal of Physiotherapy, 2020. DOI:https://doi.org/10.1016 /j.jphys.2020.03.011.
33. Files DC, Sanchez MA, Morris PE: A conceptual framework: the early and late phases of skeletal muscle dysfunction in the acute respiratory distress syndrome. Crit Care. 2015; 19:266. DOI: 10.1186/s13054-015-0979-5.
34. Kress J, Jesse B: ICU-Acquired Weakness and Recovery from Critical Illness. N Engl J Med 2014;370:1626-35. DOI: 10.1056/NEJMra1209390.
35. Zang K, Chen B, Wang M, Chen D, Hui L, Guo S et al.: The effect of early mobilization in critically ill patients: A meta-analysis. Nursing in Critical Care. 2019;1-8. DOI:10.1111/nicc.12455.
36. Bourenne J, Hraiech S, Roch A, Gainnier M, Papazian L, Forel JM: (2017) Sedation and neuromuscular blocking agents in acute respiratory distress syndrome. Ann Transl Med 5:291 55. de Backer J, Hart N, Fan E: Neuromuscular blockade in the 21st century management of the critically ill patient. Chest 2017;151:697–706.
37. Goh K, Choong MC, Cheong EH, Kalimuddin S, Duu Wen S, Phua GC, Chan KS, Haja Mohideen S: Rapid Progression to Acute Respiratory Distress Syndrome: Review of Current Understanding of Critical Illness from COVID-19 Infection. Ann Acad Med Singapore. 2020 Jan;49(1):1-9.
38. Goh K, Choong MC, Cheong EH, Kalimuddin S, Duu Wen S, Phua GC, Chan KS, Haja Mohideen S: Rapid Progression to Acute Respiratory Distress Syndrome: Review of Current Understanding of Critical Illness from COVID-19 Infection. Ann Acad Med Singapore. 2020 Jan;49(1):1-9.
39. Papazian L, Forel JM, Gacouin A, Penot-Ragon C, Perrin G, Loundou A et al.: Neuromuscular blockers in early acute respiratory distress syndrome. N Engl J Med. 2010;363(12):1107-16. Epub 2010/09/17. doi: 10.1056/NEJMoa1005372. PubMed PMID: 20843245.
40. National Heart, Lung, and Blood Institute PCTN, Moss M, Huang DT, Brower RG, Ferguson ND, Ginde AA et al.: Early neuromuscular blockade in the acute respiratory distress syndrome. N Engl J Med. 2019;380(21):1997-2008. Epub 2019/05/22. doi: 10.1056/NEJMoa1901686. PubMed PMID: 31112383; PMCID: PMC6741345
41. Wei X, Wang Z, Liao X, Guo W, Qin T, Wang S: Role of Neuromuscular Blocking Agents in Acute Respiratory Distress Syndrome: An Updated Meta-Analysis of Randomized Controlled Trials. Frontiers in Pharmacology 2020;10, art. 1637 DOI:10.3389/fphar.2019.01637.
42. Pestana É: Rehabilitation in Critical Illness and Palliative Care. In: Esquinas A., Vargas N. (eds) Ventilatory Support and Oxygen Therapy in Elder, Palliative and End-of-Life Care Patients. Springer, Cham, 2020.
43. Zhang L, Hu W, Cai Z, Liu J, Wu J, Deng Y et al.: Early mobilization of critically ill patients in the intensive care unit: a systematic review and metaanalysis. PloS One 2019;14, e0223185. DOI: 10.1371/journal.pone.0223185
44. Perme C, Nawa RK, Winkelman C, Masud F: A Tool to Assess Mobility Status in Critically Ill Patients: The Perme Intensive Care Unit Mobility Score. Methodist DeBakey Cardiovascular Journal, 2014; 10(1): 41–49. DOI:10.14797/mdcj-10-1-41.
45. Wilches LEC, Hernández NL, Siriani deOA, Kenji NR, Perme C, Gastaldi AC: Perme ICU Mobility Score (Perme Score) and the ICU Mobility Scale (IMS): translation and cultural adaptation for the Spanish language. Colomb Med (Cali). 2018;49(4):265-72. DOI: 10.25100/cm.v49i4.4042.
46. Cristancho W: Fisioterapia en la UCI. 1ª edición. Colombia: Editorial El Manual Moderno, 2012.
47. Sricharoenchai T, Parker AM, Zanni JM, Nelliot A, Dinglas VD, Needham DM: Safety of physical therapy interventions in critically ill patients: a single-center prospective evaluation of 1110 intensive care unit admissions. J Crit Care 2014;29:395–400.
48. Bailey P, Thomsen GE, Spuhler VJ, Blair R, Jewkes J, Bezdjian L, Veale K, Rodriquez L, Hopkins RO: Early activity is feasible and safe in respiratory failure patients. Crit Care Med 2007;35: 139–145.
49. Needham DM, Korupolu R: Rehabilitation quality improvement in an intensive care unit setting: implementation of a quality improvement model. Top Stroke Rehabil 2010;17:271–281.
50. Perme C, Nalty T, Winkelman C, Kenji Nawa R, Masud F: Safety and efficacy of mobility interventions in patients with femoral catheters in the ICU: a prospective observational study. Cardiopulm Phys Ther J 2013;24:12–17.
51. Nydahl P, Ruhl AP, Bartoszek G, Dubb R, Filipovic S, Flohr HJ, Kaltwasser A, Mende H, Rothaug O, Schuchhardt D et al.: Early mobilization of mechanically ventilated patients: a 1-day point-prevalence study in Germany. Crit Care Med 2014;42: 1178–1186.
52. Berney SC, Rose JW, Bernhardt J, Denehy L: Prospective observation of physical activity in critically ill patients who were intubated for more than 48 hours. J Crit Care 2015;30:658–663.
53. Hodgson C, Bellomo R, Berney S, Bailey M, Buhr H, Denehy L, Harrold M, Higgins A, Presneill J, Saxena M et al.: TEAM Study Investigators. Early mobilization and recovery in mechanically ventilated patients in the ICU: a bi-national, multi-centre, prospective cohort study. Crit Care 2015;19:81.
54. Hodgson C, Capell E, Tipping C: Early Mobilization of Patients in Intensive Care: Organization, Communication and Safety Factors that Influence Translation into Clinical Practice. Critical Care 2018;22:77. DOI: https://doi.org/10.1186/s13054-018-1998-9.
55. Dubb R, Nydahl P, Hermes C et al.: Barriers and Strategies for Early Mobilization of Patients in Intensive Care Units. Ann Am Thorac Soc 2016;13(5):724–730.










